- Историја предмета
- Општа својства калаја
- Легуре на бази коситра
- Коришћење елемента и његових веза
- Дејство једињења лименке
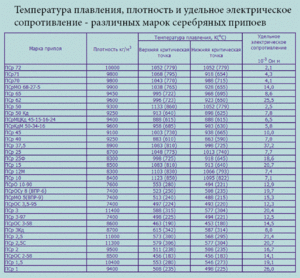 Лименка је мекан сребрно-бели метал. Толико је пробирљив и савитљив да се његови листови дебљине хиљаду милиметара могу савити у цев. Такав материјал се назива лименим папиром. У периодичној табели елемената Д. И. Менделејева, овај елемент одговара броју 50, атомске масе 118, 69 и знаку "Сн" (са латинским станнумом). Познато је 10 његових стабилних изотопа. Метал се добија углавном из минерала каситерита, који је коситрени диоксид.
Лименка је мекан сребрно-бели метал. Толико је пробирљив и савитљив да се његови листови дебљине хиљаду милиметара могу савити у цев. Такав материјал се назива лименим папиром. У периодичној табели елемената Д. И. Менделејева, овај елемент одговара броју 50, атомске масе 118, 69 и знаку "Сн" (са латинским станнумом). Познато је 10 његових стабилних изотопа. Метал се добија углавном из минерала каситерита, који је коситрени диоксид.
За лемљење се користи углавном метал у легуру са оловом. Поред тога, користи се као антикорозивни премаз за посуде од челика хране јер није токсичан. Композити са коситром користе се као фунгициди, боје, пасте за зубе (СнФ2) и керамика.
Историја предмета
 Овај елемент открио је 1854. године Халиус Пелегрин. Међутим, његова употреба почела је много пре овог датума на Блиском Истоку и Балкану око 2000. године пре нове ере. У оно доба откривена је бронза (легура кала и бакра) која је добила име бронзано доба. Произвели су брончано оружје и алате који су били ефикаснији од камена и костију.
Овај елемент открио је 1854. године Халиус Пелегрин. Међутим, његова употреба почела је много пре овог датума на Блиском Истоку и Балкану око 2000. године пре нове ере. У оно доба откривена је бронза (легура кала и бакра) која је добила име бронзано доба. Произвели су брончано оружје и алате који су били ефикаснији од камена и костију.
У стара времена производња бронзе је довела до развоја трговине између различитих земаља. У овом Старом завету постоје и референце на овај метал. Дакле, у Мезопотамији су израђивали брончано оружје, а у Старом Риму су лименом површином покривали бакарне посуде како би повећали своју корозијску отпорност.
Општа својства калаја
Сва својства овог метала могу се поделити у две велике групе : физичке и хемијске.
Физичке карактеристике
 Ово је сребрно кован метал који лако оксидира на собној температури, док се боја кала мења у тамно сиву. Ако савијете плочу од овог метала, можете чути карактеристичан звук, такозвани „лимени крик“, који настаје услед трења између његових саставних кристала. Једна од његових изражених карактеристика је оштро погоршање механичких својстава под одређеним условима, које се називају „лимена куга“: испод -18 ° Ц, метал се уништава и почиње да личи на сиви прах.
Ово је сребрно кован метал који лако оксидира на собној температури, док се боја кала мења у тамно сиву. Ако савијете плочу од овог метала, можете чути карактеристичан звук, такозвани „лимени крик“, који настаје услед трења између његових саставних кристала. Једна од његових изражених карактеристика је оштро погоршање механичких својстава под одређеним условима, које се називају „лимена куга“: испод -18 ° Ц, метал се уништава и почиње да личи на сиви прах.
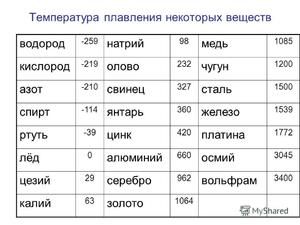
Чисти катар има две алотропне модификације: сиву и белу. Сива модификација има кубну кристалну структуру, полуводич је, веома крхка, има ниску густину и стабилна је на температурама испод 13, 2 ° Ц. Бела алотропна модификација има тетрагонску кристалну структуру, добро проводи електричну струју и стабилна је на температурама изнад 13, 2 ° Ц.
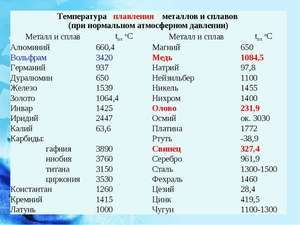
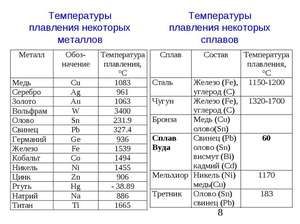
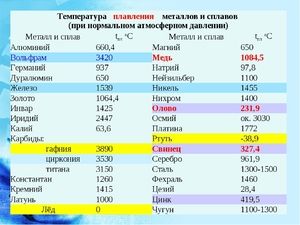
Метал се топи на релативно ниској температури од 232 ° Ц (за поређење: гвожђе се топи на 1535 ° Ц). Неопходно је разумети, одговарајући на питање, на којој температури се калај топи, шта је тачно његова таласа беле алотропне модификације. Упркос ниској тачки топљења, врење метала се дешава на релативно високој температури од 2602 ° Ц (гвожђе кључа на 2750 ° Ц).
Хемијска својства
 Најважнији минерал је каситерит, СнО2. Међутим, тренутно непозната лежишта руде са високим процентом овог минерала. Већина цасситерита у свету ископава се из неквалитетних алувијалних лежишта. Управо се из овог минерала производи кала у индустријском обиму. Због тога се каситерите дроби да се добије његов концентрат, а затим се топи заједно са коксом, кварцем и кречом у високој пећи. Након тога, одливци у облику блокова пролазе завршно чишћење од нечистоћа бизмута, бакра и гвожђа.
Најважнији минерал је каситерит, СнО2. Међутим, тренутно непозната лежишта руде са високим процентом овог минерала. Већина цасситерита у свету ископава се из неквалитетних алувијалних лежишта. Управо се из овог минерала производи кала у индустријском обиму. Због тога се каситерите дроби да се добије његов концентрат, а затим се топи заједно са коксом, кварцем и кречом у високој пећи. Након тога, одливци у облику блокова пролазе завршно чишћење од нечистоћа бизмута, бакра и гвожђа.
Хемијски елемент коситар одлично реагује и са јаким киселинама и са јаким базама, али је у неутралним растворима релативно инертан. Кородира у присуству оксидирајућег медија, у недостатку кисеоника, метал практично не кородира. За време оксидације на површини метала формира се густи оксидни филм који остатак штити од даље оксидације.
 Ако се након растварања соли у води формира кисели медијум, тада у присуству оксидационих средстава или ваздуха, коситар реагује. Такве соли укључују хлориде, на пример, алуминијум и гвожђе. Већина неводних течности, попут уља и алкохола, практично не реагују са калајем. Сам коситар и његове једноставне неорганске соли нису токсичне, али неки органски композити су токсични.
Ако се након растварања соли у води формира кисели медијум, тада у присуству оксидационих средстава или ваздуха, коситар реагује. Такве соли укључују хлориде, на пример, алуминијум и гвожђе. Већина неводних течности, попут уља и алкохола, практично не реагују са калајем. Сам коситар и његове једноставне неорганске соли нису токсичне, али неки органски композити су токсични.
Тин (ИИ) оксид, СнО је црно плави кристал који се раствара у киселинама и базама. Користи се за производњу соли у галванизацији и за производњу стакла. Тин (ИВ) оксид, СнО2 је бела прашина, нерастворљива у киселинама. Употребљава се као незамјењива компонента за бојење ружичасте, жуте и браон керамике, као и за диелектрике и ватросталне легуре. Важно је средство код полирања мермера и другог украсног камења.
Тин (ИИ) хлорид, СнЦл2 је главни састојак коситрене киселине за лемљење. Лимунски (ИВ) хлорид, СнЦл4 се користи као хемијски састојак који даје тежини свиленој тканини, као и за стабилизацију одређених парфемских производа и стабилизовање боје сапуна, а СнФ2, који је бео и растворљив у води, користи се као додатак пастама за зубе.
Органска хемијска једињења на основу овог елемента су она једињења у којима је присутна најмање једна коситрено-водонична веза, Сн-Х, и у којима метал показује оксидационо стање +4. Органска једињења која су нашла своју примјену у индустрији имају сљедеће хемијске формуле:
- Р4Сн;
- Р3СнКс;
- Р2СнКс2;
- РСнКс3.
Овде је Р органска група, на пример, метил, етил, бутил и други, а Кс је неоргански елемент, на пример, хлор, кисеоник, флора и други.
Легуре на бази коситра
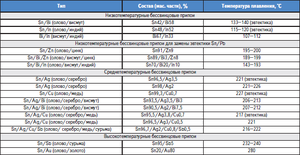 Легуре на бази калаја познате су и као бели метали, који обично садрже бакар, антимон и олово. Легуре имају различита механичка својства у зависности од њиховог састава.
Легуре на бази калаја познате су и као бели метали, који обично садрже бакар, антимон и олово. Легуре имају различита механичка својства у зависности од њиховог састава.
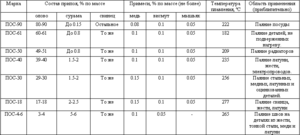
Легура калаја и олова нашле су комерцијалну употребу за широк спектар једињења. Дакле, 61, 9% коситра и 38, 1% олова одговарају еутектичком саставу, чији степен очвршћавања износи 183 ° Ц. Легуре са различитим односом ових метала се топе и кристализирају у широком температурном опсегу када постоји равнотежа између чврсте и течне фазе. Са таквом кристализацијом у талини почињу да се таложе чврсте сегрегације, што доводи до стварања различитих структура. Еутектичка легура, с обзиром да има најнижу тачку топљења, користи се као заштита од прегревања електронских компоненти.
Постоје и легуре у којима је поред ових метала присутна и мала количина антимона (до 2, 5%). Главни проблем легура на бази калаја и олова је њихов негативан утицај на животну средину, па су недавно развијене њихове замене које не користе олово, на пример, легуре са сребром и бакром.
Легура кала са оловом и антимоном користе се за украсни накит, а неке легуре кала, бакра и антимона користе се као мазиво за смањење трења у лежајевима, због својих својстава против трења. Поред горе наведених легура, калај се користи у легурама бронзе и у легурама са титаном и цирконијумом.
Коришћење елемента и његових веза
Ниже су наведена сва подручја људске производње у којима се овај елемент директно или индиректно користи:
 Заштита од корозије и механичког напрезања челика и других метала, на пример, у производњи лименки;
Заштита од корозије и механичког напрезања челика и других метала, на пример, у производњи лименки;- Смањење крхкости стакла, као и у производњи огледала;
- У потјераним узорцима на разним јелима;
- Употреба у фунгицидима, бојама, пастама за зубе и разним пигментима.
- Након примања разних легура, на пример, бронза.
- За лемљење на ниским температурама или меко лемљење;
- Састављен од олова у производњи металних плоча за музичке инструменте;
- Производњом етикета разних производа;
- У легурама које штите од прегревања електричних апарата и електронских микровељака;
- У индустрији керамике за производњу емајла као матирајућег средства.
- У капсулама за затварање винских боца. Производња таквих капсула проширила се након забране употребе олова у прехрамбеној индустрији.
Дејство једињења лименке
Активност једињења са овим елементом, на овај или онај начин, утиче на људско тело и на животну средину.
О људском здрављу
 Као што је већ поменуто, најопасније за здравље људи су органска хемијска једињења калаја. Ове супстанце се широко користе у индустрији, на пример, у производњи боја, пластике и пестицида за пољопривреду. Поред тога, производња органских једињења са овим металом константно расте, упркос чињеници да су последице тровања њима познате .
Као што је већ поменуто, најопасније за здравље људи су органска хемијска једињења калаја. Ове супстанце се широко користе у индустрији, на пример, у производњи боја, пластике и пестицида за пољопривреду. Поред тога, производња органских једињења са овим металом константно расте, упркос чињеници да су последице тровања њима познате .
Утицај ових супстанци на људе је разнолик, све зависи од врсте једињења и од индивидуалних карактеристика тела. Опасност од једињења је у корелацији са дужином везе метала и водоника, што је ова веза дужа, то је веза мање опасна. С тим у вези, једињење калаја са три етил групе, чије су водоничне везе релативно кратке, сматра се најопаснијом органском супстанцом.
Те материје могу ући у људско тело путем хране, капљицама из ваздуха или једноставним додиром. Познати су следећи ефекти дејства органских једињења кала на људско тело:
- Када се налази у соби у којој се налазе паре овог метала, јака иритација горњих дисајних путева, коже и очију;
- Главобоља, болови у стомаку и недостатак апетита;
- Мучнина и повраћање;
- Проблеми са мокрењем;
- Јако знојење и недостатак даха.
Наведени ефекти могу довести до озбиљнијих последица:
- Депресија
- Проблеми са јетром;
- Ослабљен имуни систем
- Оштећења ћелијских хромозома и недостатак црвених тела у крви;
- Оштећење мозга (поремећаји спавања, главобоље, оштећења памћења, раздражено стање).
За околину
 И атоми калаја и сам метал у чистом стању нису токсични за било који организам на земљи, заузврат, скоро сва једињења са овим елементом органске природе су штетна. Ова једињења могу бити у окружењу током дужег временског периода. Они су прилично стабилни и практично се не распадају под утицајем микроорганизама, због својих снажних водоничних веза. Без обзира колико су мале концентрације једињења овог метала у земљи и води, с обзиром на горе наведено, они стално расту.
И атоми калаја и сам метал у чистом стању нису токсични за било који организам на земљи, заузврат, скоро сва једињења са овим елементом органске природе су штетна. Ова једињења могу бити у окружењу током дужег временског периода. Они су прилично стабилни и практично се не распадају под утицајем микроорганизама, због својих снажних водоничних веза. Без обзира колико су мале концентрације једињења овог метала у земљи и води, с обзиром на горе наведено, они стално расту.
Познато је да органска једињења кана наносе велику штету воденим екосистемима јер су отровна за гљивице, алге и фитопланктон. Фитопланктон је важан део воденог екосистема, јер ствара кисеоник за све остале живе организме овог система, а такође је важан део ланца исхране. Токсичност једињења калаја је различита за различита жива бића, на пример, трибутил коситар је токсичан за рибу и гљиве, док је трифенол-кала најтоксичније једињење фитопланктона.
Такође је познато да органска једињења овог елемента негативно утичу на раст и репродуктивну функцију животиња, нарушавају рад ензима. Таква једињења се накупљају углавном у горњим слојевима земље и воде.